ہیومن بیٹا ایمیلائڈ (1-42) پروٹین، جسے Aβ1-42 بھی کہا جاتا ہے، الزائمر کی بیماری کے اسرار کو کھولنے میں ایک اہم عنصر ہے۔یہ پیپٹائڈ ایمیلائڈ پلاک کی تشکیل میں مرکزی کردار ادا کرتا ہے، الزائمر کے مریضوں کے دماغ کو نقصان پہنچانے والے خفیہ کلسٹرز۔تباہ کن اثر کے ساتھ، یہ نیورونل کمیونیکیشن میں خلل ڈالتا ہے، سوزش کو متحرک کرتا ہے، اور نیوروٹوکسائٹی پیدا کرتا ہے، جس سے علمی خرابی اور اعصابی نقصان ہوتا ہے۔اس کے جمع ہونے اور زہریلے طریقہ کار کی چھان بین نہ صرف ضروری ہے۔یہ الزائمر کی پہیلی کو حل کرنے اور مستقبل کے علاج کو تیار کرنے کی طرف ایک دلچسپ سفر ہے۔



Aβ 1-42 42 امینو ایسڈز کا ایک پیپٹائڈ ٹکڑا ہے جو β- اور γ-secretases کے ذریعے amyloid precursor protein (APP) کے کلیویج سے اخذ کیا گیا ہے۔Aβ 1-42 amyloid تختیوں کے اہم اجزاء میں سے ایک ہے جو الزائمر کے مرض میں مبتلا مریضوں کے دماغوں میں جمع ہوتا ہے، یہ ایک اعصابی خرابی ہے جس کی خصوصیت علمی خرابی اور یادداشت کی کمی ہے۔Aβ 1-42 کو حیاتیاتی اور حیاتیاتی تحقیق میں مختلف افعال اور اطلاقات دکھائے گئے ہیں، جیسے:
1. نیوروٹوکسائٹی: Aβ 1-42 گھلنشیل اولیگومر تشکیل دے سکتا ہے جو نیورونل جھلیوں، رسیپٹرز اور synapses کے کام کو پابند کرنے اور اس میں خلل ڈالنے کی صلاحیت رکھتا ہے۔یہ اولیگومر نیوران میں آکسیڈیٹیو تناؤ، سوزش اور اپوپٹوس کو بھی آمادہ کر سکتے ہیں، جس سے Synaptic نقصان اور نیورونل موت واقع ہوتی ہے۔Aβ 1-42 oligomers کو Aβ کی دوسری شکلوں سے زیادہ نیوروٹوکسک سمجھا جاتا ہے، جیسے Aβ 1-40، جو دماغ میں Aβ کی سب سے زیادہ پرچر شکل ہے۔Aβ 1-42 oligomers کے بارے میں بھی خیال کیا جاتا ہے کہ وہ ایک خلیے سے دوسرے خلیے تک پھیلنے کے قابل ہوتے ہیں، پرائینز کی طرح، اور دوسرے پروٹینوں کی غلط فولڈنگ اور جمع کو متحرک کرتے ہیں، جیسے کہ تاؤ، جو الزائمر کی بیماری میں نیوروفائبریلری ٹینگلز بناتا ہے۔
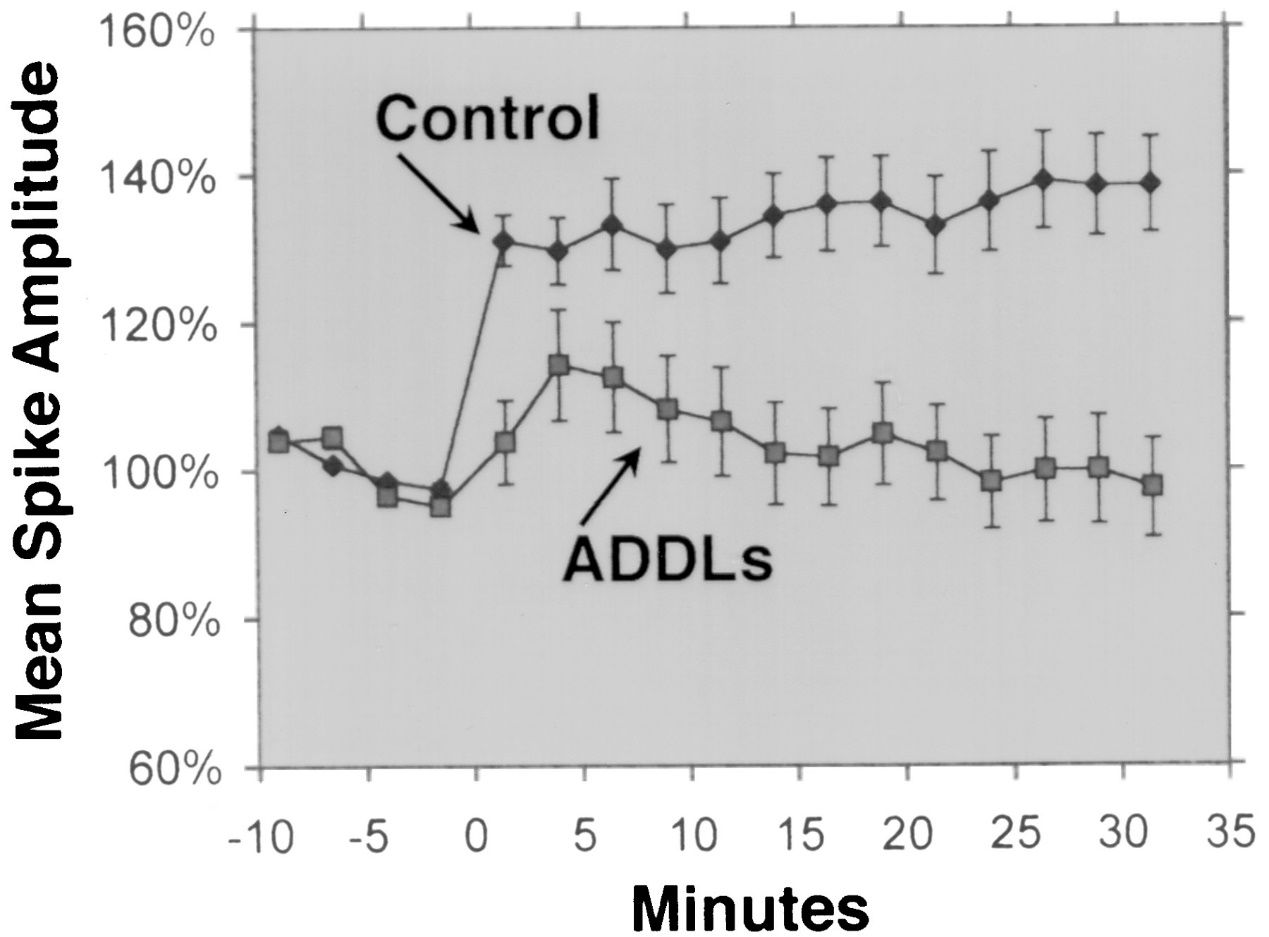
Aβ 1-42 کو بڑے پیمانے پر Aβ isoform کے طور پر جانا جاتا ہے جس میں سب سے زیادہ نیوروٹوکسائٹی ہے۔متعدد تجرباتی مطالعات نے مختلف طریقوں اور ماڈلز کا استعمال کرتے ہوئے Aβ 1-42 کی نیوروٹوکسائٹی کا مظاہرہ کیا ہے۔مثال کے طور پر، Lesné et al.(دماغ، 2013) نے Aβ oligomers کی تشکیل اور زہریلے پن کی چھان بین کی، جو Aβ monomers کے گھلنشیل مجموعے ہیں، اور یہ ظاہر کیا کہ Aβ 1-42 oligomers کا نیورونل synapses پر مضبوط نقصان دہ اثر ہوتا ہے، جس سے علمی زوال اور اعصابی نقصان ہوتا ہے۔لیمبرٹ وغیرہ۔(پروسیڈنگز آف دی نیشنل اکیڈمی آف سائنسز، 1998) نے Aβ 1-42 oligomers کی نیوروٹوکسیٹی کو اجاگر کیا اور پایا کہ ان کا مرکزی اعصابی نظام پر شدید زہریلا اثر ہے، ممکنہ طور پر Synapses اور neurotransmitters کو متاثر کر کے۔والش وغیرہ۔(نیچر، 2002) نے Vivo میں ہپپوکیمپل لانگ ٹرم پوٹینشن (LTP) پر Aβ 1-42 oligomers کے روکے ہوئے اثر کو دکھایا، جو کہ سیکھنے اور یادداشت کے تحت ایک سیلولر میکانزم ہے۔یہ روکنا میموری اور سیکھنے کی خرابی سے منسلک تھا، جس میں Synaptic پلاسٹکٹی پر Aβ 1-42 oligomers کے اثرات پر زور دیا گیا تھا۔شنکر وغیرہ۔(نیچر میڈیسن، 2008) نے الزائمر کے دماغ سے براہ راست Aβ 1-42 dimers کو الگ تھلگ کیا اور Synaptic plasticity اور میموری پر اپنا اثر دکھایا، Aβ 1-42 oligomers کی neurotoxicity کے تجرباتی ثبوت فراہم کیا۔
اس کے علاوہ، Su et al.(مالیکیولر اینڈ سیلولر ٹاکسیکولوجی، 2019) نے SH-SY5Y نیوروبلاسٹوما خلیوں میں Aβ 1-42-حوصلہ افزائی نیوروٹوکسائٹی کا ٹرانسکرپٹومکس اور پروٹومکس تجزیہ کیا۔انہوں نے کئی جینز اور پروٹینز کی نشاندہی کی جو اپوپٹوٹک پروسیس، پروٹین ٹرانسلیشن، سی اے ایم پی کیٹابولک عمل اور اینڈوپلاسمک ریٹیکولم تناؤ کے ردعمل سے متعلق راستوں میں Aβ 1-42 سے متاثر ہوئے تھے۔تاکیدا وغیرہ۔(بائیولوجیکل ٹریس ایلیمنٹ ریسرچ، 2020) نے الزائمر کی بیماری میں Aβ 1-42-حوصلہ افزائی نیوروٹوکسیسیٹی میں ایکسٹرا سیلولر Zn2+ کے کردار کی تحقیقات کی۔انہوں نے ظاہر کیا کہ Aβ 1-42-حوصلہ افزائی انٹرا سیلولر Zn2+ زہریلا بڑھاپے کے ساتھ تیز ہوا کیونکہ ایکسٹرا سیلولر Zn2+ میں عمر سے متعلق اضافے کی وجہ سے۔انہوں نے تجویز کیا کہ نیورون ٹرمینلز سے مسلسل چھپنے والا Aβ1-42 عمر سے متعلق علمی کمی اور انٹرا سیلولر Zn2+ dysregulation کے ذریعے نیوروڈیجنریشن کا سبب بنتا ہے۔ان مطالعات سے پتہ چلتا ہے کہ دماغ میں مختلف مالیکیولر اور سیلولر عمل کو متاثر کرکے الزائمر کی بیماری میں نیوروٹوکسائٹی اور بیماری کے بڑھنے میں ثالثی کرنے میں Aβ1-42 ایک اہم عنصر ہے۔
2. اینٹی مائکروبیل سرگرمی: Aβ 1-42 میں مختلف پیتھوجینز، جیسے بیکٹیریا، فنگس اور وائرس کے خلاف جراثیم کش سرگرمی کی اطلاع دی گئی ہے۔Aβ 1-42 مائکروبیل خلیوں کی جھلیوں کو باندھ سکتا ہے اور ان میں خلل ڈال سکتا ہے، جس سے ان کے لیسز اور موت واقع ہو سکتی ہے۔Aβ 1-42 پیدائشی مدافعتی نظام کو بھی فعال کر سکتا ہے اور سوزش کے خلیوں کو انفیکشن کی جگہ پر بھرتی کر سکتا ہے۔کچھ مطالعات نے تجویز کیا ہے کہ دماغ میں Aβ کا جمع ہونا دائمی انفیکشن یا چوٹوں کا حفاظتی ردعمل ہو سکتا ہے۔تاہم، Aβ کی ضرورت سے زیادہ یا غیر منظم پیداوار بھی میزبان خلیوں اور بافتوں کو کولیٹرل نقصان پہنچا سکتی ہے۔
Aβ 1-42 کو متعدد پیتھوجینز، جیسے کہ بیکٹیریا، فنگس، اور وائرسز، جیسے Staphylococcus aureus، Escherichia coli، Candida albicans، اور Herpes Simplex وائرس قسم 1 کے خلاف جراثیم کش سرگرمی ظاہر کرنے کی اطلاع دی گئی ہے، ان کی جھلیوں کے ساتھ تعامل کرتے ہوئے اور ان کی رکاوٹ اور lysis کی وجہ سے.کمار وغیرہ۔(جرنل آف الزائمر ڈیزیز، 2016) نے اس اثر کو یہ دکھا کر ظاہر کیا کہ Aβ1-42 نے مائکروبیل خلیوں کی جھلی کی پارگمیتا اور مورفولوجی کو تبدیل کر دیا، جس سے ان کی موت واقع ہوئی۔اس کے براہ راست antimicrobial عمل کے علاوہ، Aβ 1-42 پیدائشی مدافعتی ردعمل کو بھی بدل سکتا ہے اور سوزش کے خلیوں کو انفیکشن کی جگہ پر بھرتی کر سکتا ہے۔Soscia et al.(PLoS One، 2010) نے اس کردار کا انکشاف یہ رپورٹ کرتے ہوئے کیا کہ Aβ 1-42 پرو سوزش والی سائٹوکائنز اور کیموکینز کی پیداوار کو متحرک کرتا ہے، جیسے کہ انٹرلییوکن-6 (IL-6)، ٹیومر نیکروسس فیکٹر-الفا (TNF-α)، مونوسائٹ۔ کیموآٹریکٹینٹ پروٹین-1 (MCP-1)، اور میکروفیج انفلامیٹری پروٹین-1 الفا (MIP-1α)، مائیکروگلیہ اور ایسٹروسائٹس میں، دماغ کے اہم مدافعتی خلیات۔
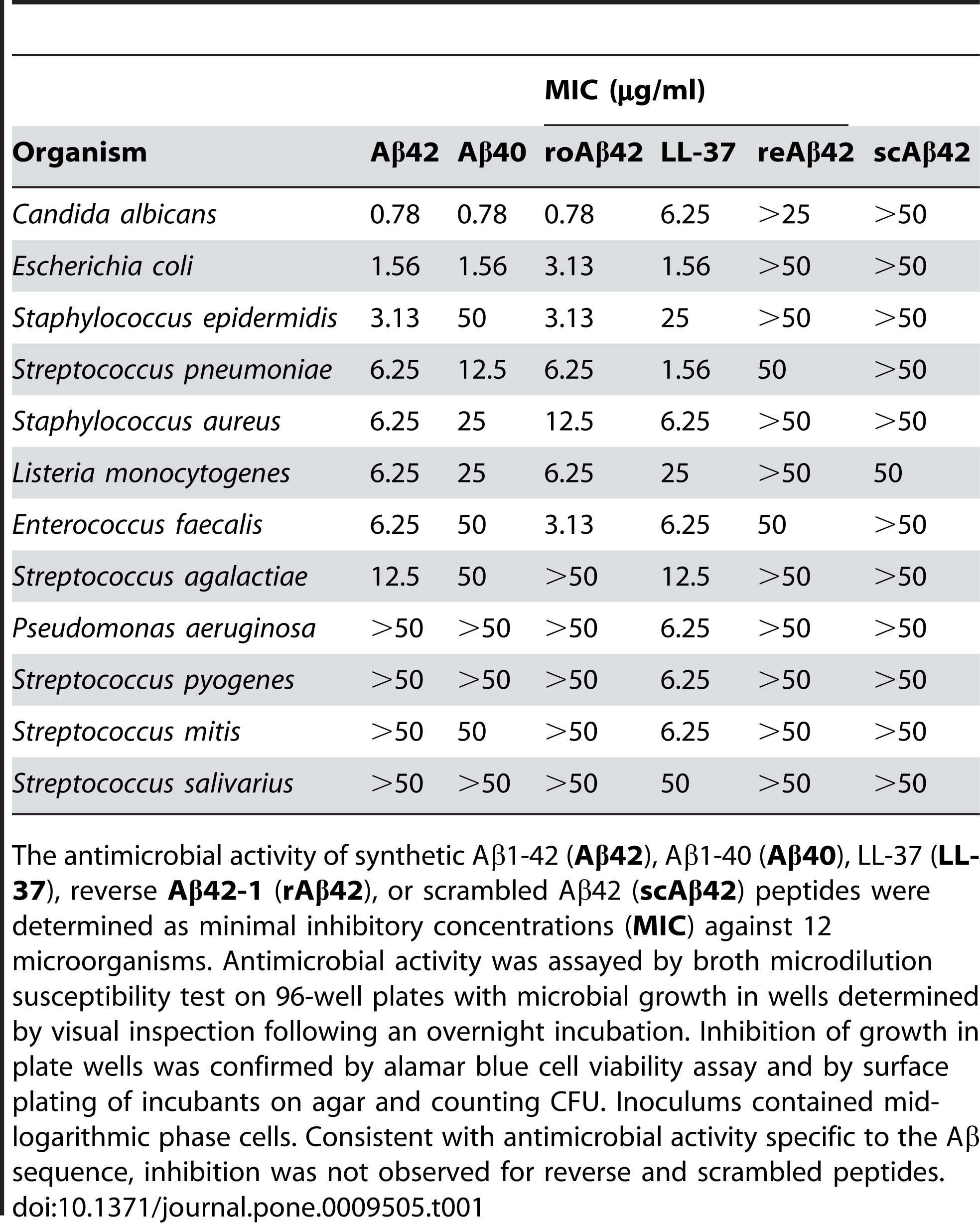
شکل 2. Aβ پیپٹائڈس اینٹی مائکروبیل سرگرمی رکھتے ہیں۔
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. الزائمر کی بیماری سے وابستہ امائلائڈ بیٹا پروٹین ایک اینٹی مائکروبیل پیپٹائڈ ہے۔ PLOS One 2010 مارچ 3؛ 5(3):e9505۔)
اگرچہ کچھ مطالعات نے تجویز کیا ہے کہ دماغ میں Aβ کا جمع ہونا دائمی انفیکشن یا چوٹوں کے لیے حفاظتی ردعمل ہو سکتا ہے، کیونکہ Aβ ایک antimicrobial peptide (AMP) کے طور پر کام کر سکتا ہے اور ممکنہ پیتھوجینز کو ختم کر سکتا ہے، Aβ اور مائکروبیل عناصر کے درمیان پیچیدہ تعامل باقی رہتا ہے۔ تحقیقات کا موضوع.موئیر ایٹ ال کی تحقیق سے نازک توازن کو اجاگر کیا گیا ہے۔(جرنل آف الزائمر ڈیزیز، 2018)، جو بتاتا ہے کہ غیر متوازن یا ضرورت سے زیادہ Aβ کی پیداوار نادانستہ طور پر میزبان خلیوں اور بافتوں کو نقصان پہنچا سکتی ہے، جو انفیکشن اور نیوروڈیجنریشن میں Aβ کے کردار کی پیچیدہ دوہری نوعیت کی عکاسی کرتی ہے۔Aβ کی ضرورت سے زیادہ یا غیر منظم پیداوار دماغ میں اس کے جمع ہونے اور جمع ہونے کا باعث بن سکتی ہے، زہریلے oligomers اور fibrils جو کہ نیورونل فنکشن کو نقصان پہنچاتے ہیں اور نیوروئن سوزش پیدا کرتے ہیں۔یہ پیتھولوجیکل عمل الزائمر کی بیماری میں علمی زوال اور یادداشت کی کمی سے وابستہ ہیں، جو کہ ترقی پسند ڈیمنشیا کی خصوصیت سے ایک نیوروڈیجینریٹو عارضہ ہے۔لہذا، دماغی صحت کو برقرار رکھنے اور نیوروڈیجنریشن کو روکنے کے لیے Aβ کے فائدہ مند اور نقصان دہ اثرات کے درمیان توازن بہت ضروری ہے۔
3. لوہے کی برآمد: Aβ 1-42 کو دماغ میں آئرن ہومیوسٹاسس کے ضابطے میں ملوث دکھایا گیا ہے۔آئرن بہت سے حیاتیاتی عملوں کے لیے ایک لازمی عنصر ہے، لیکن اضافی آئرن آکسیڈیٹیو تناؤ اور نیوروڈیجنریشن کا سبب بھی بن سکتا ہے۔Aβ 1-42 لوہے سے منسلک ہو سکتا ہے اور فیروپورٹین کے ذریعے نیوران سے اس کی برآمد کو آسان بنا سکتا ہے، جو کہ ایک ٹرانس میبرن آئرن ٹرانسپورٹر ہے۔اس سے دماغ میں آئرن کے جمع ہونے اور زہریلے پن کو روکنے میں مدد مل سکتی ہے، کیونکہ زیادہ آئرن آکسیڈیٹیو تناؤ اور نیوروڈیجنریشن کا سبب بن سکتا ہے۔Duce et al.(سیل، 2010) نے اطلاع دی ہے کہ Aβ 1-42 فیروپورٹن کا پابند ہے اور نیوران میں اس کے اظہار اور سرگرمی کو بڑھاتا ہے، جس سے انٹرا سیلولر آئرن کی سطح کم ہوتی ہے۔انہوں نے یہ بھی ظاہر کیا کہ Aβ 1-42 نے ہیپسیڈن کے اظہار کو کم کیا، ایک ہارمون جو فیروپورٹن کو روکتا ہے، ایسٹروائٹس میں، نیوران سے آئرن کی برآمد کو مزید بڑھاتا ہے۔تاہم، لوہے سے منسلک Aβ بھی خلیے کی جگہ میں جمع ہونے اور جمع ہونے کا زیادہ خطرہ بن سکتا ہے، جس سے امائلائیڈ تختیاں بنتی ہیں۔Ayton et al.(جرنل آف بائیولوجیکل کیمسٹری، 2015) نے رپورٹ کیا کہ آئرن نے وٹرو اور ویوو میں Aβ oligomers اور fibrils کی تشکیل کو فروغ دیا۔انہوں نے یہ بھی ظاہر کیا کہ آئرن کیلیشن نے Aβ جمع اور ٹرانسجینک چوہوں میں جمع ہونے کو کم کیا۔لہذا، آئرن ہومیوسٹاسس پر Aβ1-42 کے فائدہ مند اور نقصان دہ اثرات کے درمیان توازن دماغی صحت کو برقرار رکھنے اور نیوروڈیجنریشن کو روکنے کے لیے بہت ضروری ہے۔
ہم چین میں پولی پیپٹائڈ بنانے والے ہیں، پولی پیپٹائڈ کی تیاری میں کئی سالوں کا تجربہ کار ہے۔Hangzhou Taijia Biotech Co., Ltd. ایک پیشہ ور پولی پیپٹائڈ خام مال تیار کرنے والا ادارہ ہے، جو دسیوں ہزار پولی پیپٹائڈ خام مال فراہم کر سکتا ہے اور ضرورت کے مطابق اپنی مرضی کے مطابق بھی بنایا جا سکتا ہے۔پولی پیپٹائڈ مصنوعات کا معیار بہترین ہے، اور پاکیزگی 98% تک پہنچ سکتی ہے، جسے پوری دنیا کے صارفین نے تسلیم کیا ہے۔ ہم سے مشورہ کرنے میں خوش آمدید۔






